2020年11月9日,中生尚健生物医药(杭州)有限公司(以下简称中生尚健)宣布其向国家药品监督管理局(NMPA)药品审评中心(CDE)提交的靶向CD47的SG404项目新药临床试验申请(IND)获批临床。这是中生尚健自2020年3月成立以来的首个项目获批临床。
近十年来,CD47-SIRPα信号通路已经成为了肿瘤免疫治疗的一个潜在靶点。去年12月,在ASH会议上,Forty Seven发布其CD47抗体magrolimab联合azacitidine治疗使得先前未经治疗的高风险骨髓增生异常综合症的总缓解率(ORR)达到92%,先前未经治疗的急性髓系白血病的ORR达到64%。这些积极的数据为其他开发抗CD47疗法的公司带来了很大的鼓舞。2020年3月,制药巨头吉利德(Gilead)宣布将斥资49亿美元收购Forty Seven。
据NextPharma数据库显示,目前全球有超过50个在研抗CD47疗法,其中有近20个候选药物已经在开展临床研究。不过,尽管目前已有多个候选药物进入临床试验,但红细胞毒性等痛点问题仍然是CD47靶点成药性争议的焦点所在;如何设计出更安全、有效的CD47靶向药物仍是努力的方向。
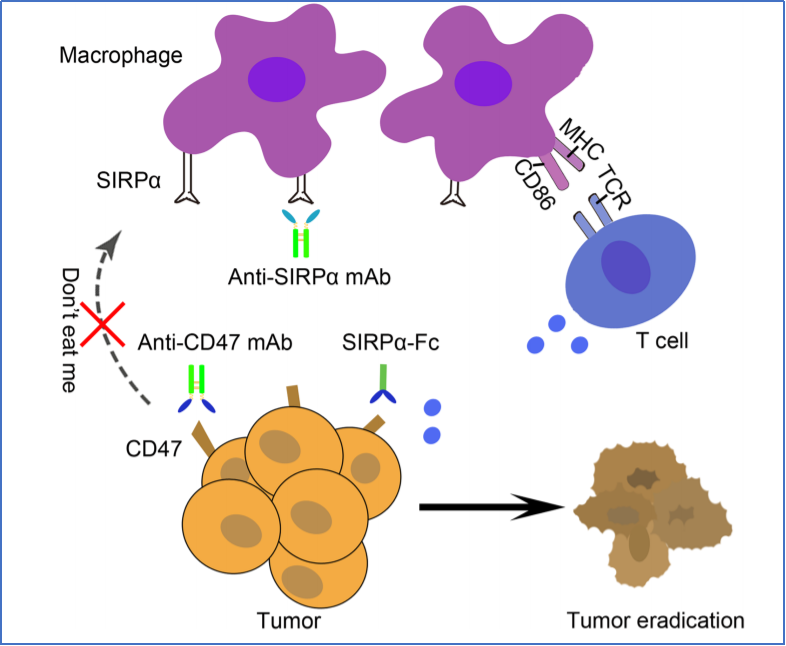
图片来源:JBC
SG404项目由尚健生物自主开发的重组人SIRPα-Fc融合蛋白,通过亲和力及结构优化,可有效阻断CD47-SIPRα“别吃我”信号通路,且不引起红细胞凝集,临床前研究显示出显著优于同类分子的安全性和有效性。中生尚健拥有SG404项目在中国(包含台湾、香港、澳门)的开发权,尚健生物拥有除中国以外的全球开发权益。
尚健生物联合创始人兼中生尚健副总缪仕伟博士表示:“我们很高兴SG404项目在中国获批临床。SG404是中生尚健首个获批临床的项目,也是尚健生物今年继SG301项目获FDA批准临床后,又一个自主研发的创新药获批进入临床。SG404兼顾了CD47靶点安全性和有效性的优势,有望在该靶点的新药开发中呈现竞争优势。SG404美国FDA的IND申请工作也在准备过程中。我们将快速推进包括SG404在内的多个创新抗体品种开发,尽早为广大癌症患者提供优质的中国抗体。”
中生尚健
中生尚健是杭州尚健生物技术有限公司(尚健生物)和中国生物技术股份有限公司(国药中国生物)成立的合资公司,依托尚健生物的创新能力和产品研发优势,以及国药中国生物的临床开发和商业化优势,共同开展创新抗体药物开发及商业化。
国药中国生物
国药中国生物隶属于中国医药集团有限公司(国药集团),是中国最大的从事生物制品研发、生产和经营的生物技术企业集团。公司有着百年的历史积淀,并始终坚持科技创新为引擎。国药中国生物拥有一支包括中国工程院院士在内的生物技术专家团队、众多生物制品品种以及强大的产业化能力,是中国生物医药领域的国家队。
尚健生物
尚健生物专注于肿瘤等重大疾病治疗的创新抗体药物研发和商业化,是一家进入临床研究阶段的创新生物制药企业。尚健团队具有丰富的抗体新药研发及产业化经验,围绕肿瘤领域布局了丰富的产品管线。公司正规划建设符合国际标准的抗体药物生产基地。尚健生物的目标是成为国际领先、具有持续创新能力的生物制药企业。